경동맥화학색전술
개요
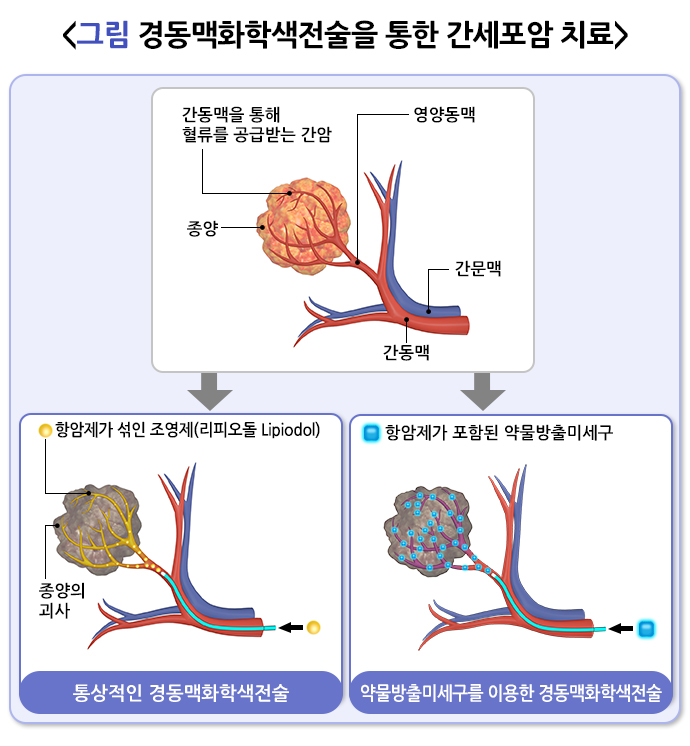
종양에 산소와 영양을 공급하는 동맥을 영양동맥이라고 합니다. 경동맥화학색전술(trans-arterial chemoembolization)은 영양동맥에 항암제가 섞인 혈류차단물질을 주입해 종양을 사멸시키는 치료법으로 간세포암종 환자에서 흔히 시행합니다. 이렇게 영양동맥만 선택적으로 차단하면 정상 간 조직의 손상을 최소화하면서 치료 효과를 극대화할 수 있습니다.
경동맥화학색전술에는 리피오돌을 이용한 통상적 경동맥화학색전술과 약물방출미세구를 이용한 경동맥화학색전술이 있습니다. 리피오돌은 1980년대부터 간종양의 경동맥화학색전술에 사용되었습니다. 간동맥으로 주입할 경우 10 μm 크기의 혈관을 차단합니다. 통상적 경동맥화학색전술은 우선 리피오돌과 항암제를 섞어서 유탁액(에멀젼)을 만든 후 간세포암의 영양동맥에 주입합니다. 이어서 젤라틴 스펀지 입자 등의 혈류차단물질을 주입해 종양의 산소 및 영양 공급 부족을 유발하고 항암제에 의한 세포독성으로 종양을 사멸시킵니다.
약물방출미세구를 이용한 경동맥화학색전술은 통상적 경동맥화학색전술과 거의 동일하지만, 혈류차단물질이 다릅니다. 약물방출미세구는 폴리비닐알코올이나 하이드로겔 기반 합성 고분자로 만들어진 미세한 구형입자로 항암제를 탑재할 수 있습니다. 리피오돌 유탁액보다 항암제가 서서히 방출되어, 전신 혈류로 빠져나가는 항암제가 크게 감소하므로 종양 내 항암제 농도가 높게 유지됩니다. 통상적 경동맥화학색전술과 치료 효과는 거의 비슷하지만, 색전후증후군이 더 적어 입원 기간이 짧다는 장점도 있습니다.
치료의 적응증
경동맥화학색전술은 간이식, 간절제, 국소치료 등 근치적 치료를 적용하기 어려운 간세포암종 환자에서 흔히 시행합니다. 서양과 달리 국내에서는 국소적으로 간문맥을 침범한 종양에 항암치료를 대신해 시행하며, 종양의 파열로 인해 출혈이 있는 경우에도 시행합니다.
치료 관련 검사
[사전 검사]
경동맥화학색전술을 시행하기 전 간절제, 담도소화관 문합술, 담도계 시술 등 간담도계 치료 이력, 당뇨 등 동반 질환, 전신수행상태, 간 기능 혈액검사 등을 평가합니다. 역동적 조영증강 CT 또는 MRI(세포외액 조영제 혹은 간세포 특이 조영제)로 종양의 크기, 위치, 범위, 형태, 혈관 침범, 복수, 비장 종대, 문맥체정맥 측부순환(portosystemic collateral) 등을 평가하고, 간동맥의 해부학적 구조와 측부순환 동맥의 가능성 및 관련 해부학을 확인합니다. 사전 영상검사와 경동맥화학색전술 사이의 간격은 가급적 두 달을 넘지 않는 것이 좋습니다. 알파태아단백이나 피브카-II와 같은 간세포암 종양 표지자 수치도 확인해 치료 후 반응 평가에 이용합니다.
치료 방법
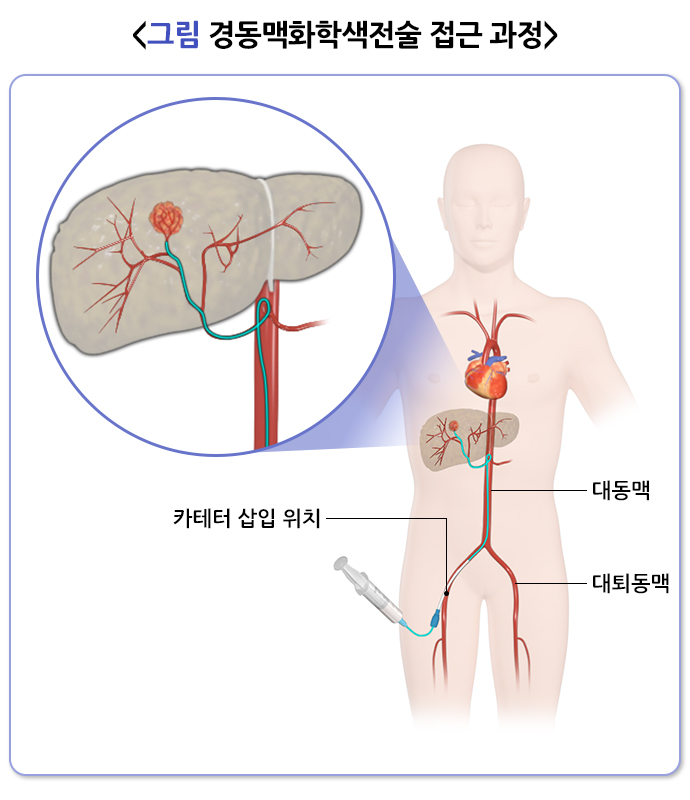
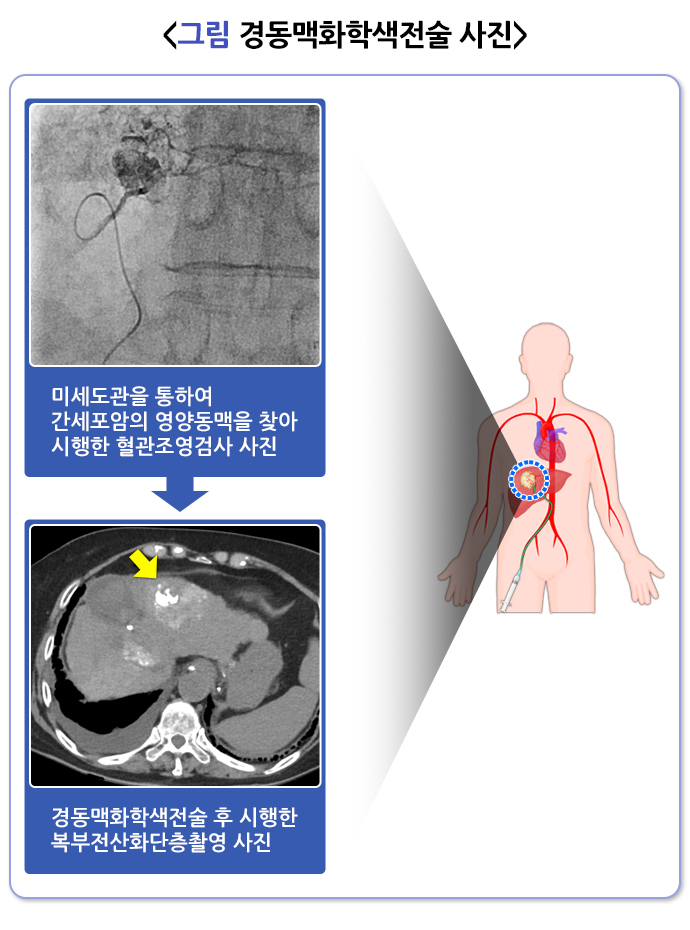
경동맥화학색전술을 위해서는 우선 동맥으로 도관을 삽입해야 하는데, 비교적 안전하게 접근할 수 있는 대퇴동맥을 가장 흔히 사용합니다. 주로 오른쪽 사타구니와 고관절 부위를 지나가는 대퇴동맥에 약 2 mm 굵기의 도관삽입용 도입기 (sheath)를 먼저 삽입해 안전한 통로를 확보한 후, 혈관조영 카테터를 삽입해 대동맥을 거쳐 복강동맥으로 접근합니다. 이후 혈관조영검사3를 시행해 간동맥의 해부학적 구조와 종양의 위치 및 공급혈관 등을 파악합니다. 필요한 경우 여러 각도에서 간동맥조영술을 시행합니다. 혈관 조영 장비의 발전으로 콘빔 전산화단층촬영(cone-beam CT)이 널리 보급되면서 3차원 영상을 이용해 보다 정확하게 치료계획을 세울 수 있게 되었습니다.
혈관조영 카테터 안으로 더 가는 마이크로카테터를 삽입해 종양의 영양동맥을 통해 종양에 가까이 접근한 후 치료물질을 주입합니다. 간동맥의 해부학적 구조와 병변의 위치, 범위에 따라 차이가 있지만, 최대한 종양 가까이 위치한 동맥을 찾아(superselective) 치료물질을 주입해 정상 간조직을 보존해야 합니다.
종양의 크기와 개수, 영양동맥의 굵기와 개수, 간동맥의 해부학적 변이, 꼬불꼬불한 주행경로가 환자마다 다르므로 소요 시간도 크게 다르지만, 총 시술 시간은 대개 30분에서 2시간 이상이 걸립니다.
치료 관련 합병증 및 부작용
1. 색전후증후군
경동맥화학색전술 시행 후 발생하는 가장 흔한 합병증은 통증, 구역, 구토, 발열 등으로 이를 색전후증후군이라고 합니다. 간실질의 허혈, 간피막의 팽창, 담낭동맥 색전에 의한 담낭 허혈 등이 원인이며, 종양의 크기나 위치에 따라 통증을 느끼는 정도와 위치가 달라질 수 있습니다. 보통 3∼4일 내에 소실되는 자기한정적(self-limiting) 합병증이지만, 이로 인해 입원 기간이 길어지거나 추가 치료가 늦어질 수 있습니다. 특히 고령의 환자나 기저질환이 있는 경우, 종양의 크기가 큰 경우에 회복 기간이 길고 치명적인 결과를 초래할 수 있습니다.
2. 담도 손상 및 간농양
비선택적 색전술로 동맥 분지가 광범위하게 손상되면 담관주위 혈관총(peribiliary plexus)이 막혀 담관벽의 허혈을 초래하고 담관 협착, 담즙종 등이 생길 수 있습니다. 간농양은 0.2∼2% 빈도로 보고되는 치명적인 합병증으로, 주문맥 폐색이나 담도계 이상이 있는 경우 발생 빈도가 높습니다. 특히 담도-장관 문합술은 가장 중요한 위험인자로, 시술 전 예방적 항생제 투여를 권장합니다.
3. 급성 간부전
급성 간부전은 경동맥화학색전술의 가장 심각한 합병증입니다. 보존적 치료로 회복 가능하지만, 드물게 비가역성 간부전으로 진행할 수 있습니다. 주문맥 폐색, 과빌리루빈혈증, 항암제 과다 사용 및 광범위한 색전술, 심한 간경화 등이 비가역성 간부전의 위험인자로 여겨집니다.
4. 혈관 손상
대퇴동맥에 관을 삽입하는 과정에서 환자는 사타구니 쪽에 통증을 느낄 수 있고, 시술 후 멍이 들거나 붓는 경우가 있지만 수 일 내에 자연 치유됩니다. 동맥 박리는 복강동맥과 고유간동맥에 잘 생기는데, 대부분 저절로 치유되나 드물게 완전 폐색이나 가성동맥류로 진행할 수 있습니다. 최근 혈관조영 카테터의 발전과 마이크로카테터의 사용으로 인해 발생 빈도가 크게 줄었습니다.
치료 후 관리
경동맥화학색전술이 끝나면 도관을 삽입했던 대퇴동맥을 지혈합니다. 대퇴동맥은 큰 혈관이므로 손으로 10~20분 정도 압박 지혈한 후, 재출혈을 방지하기 위해 6~8시간 정도 고관절을 구부리지 않고 편 채로 모래주머니 등을 올려놓아 추가 압박을 합니다. 이처럼 손으로 압박하는 경우 지혈 시간이 오래 걸리므로, 지혈 후 빠른 보행을 위해 여러가지 지혈기구를 사용할 수 있습니다. 1~3개월 후 역동적 조영증강 CT 또는 MRI(세포외액 조영제 혹은 간세포 특이 조영제)를 시행해 치료 효과와 합병증 발생 유무 등을 확인합니다. 이후 환자의 상태와 간세포암의 진행상황에 따라 정기적인 추적관찰을 하면서 필요한 경우 다양한 추가 치료를 받을 수 있습니다.
참고문헌
1. Korean Liver Cancer Association (KLCA), & National Cancer Center (NCC). (2019). 2018 Korean Liver Cancer Association–National Cancer Center Korea practice guidelines for the management of hepatocellular carcinoma. Korean Journal of Radiology, 20(7), 1042–1113. https://doi.org/10.3348/kjr.2019.0201
2. Clark, T. W. (2006). Complications of hepatic chemoembolization. Seminars in Interventional Radiology, 23(2), 119–125. https://doi.org/10.1055/s-2006-941444
3. Han, K., & Kim, J. H. (2015). Transarterial chemoembolization in hepatocellular carcinoma treatment: Barcelona clinic liver cancer staging system. World Journal of Gastroenterology, 21(36), 10327–10335. https://doi.org/10.3748/wjg.v21.i36.10327
4. Lencioni, R., de Baere, T., Soulen, M. C., Rilling, W. S., & Geschwind, J. F. (2016). Lipiodol transarterial chemoembolization for hepatocellular carcinoma: A systematic review of efficacy and safety data. Hepatology, 64(1), 106–116. https://doi.org/10.1002/hep.28453
5. Ogasawara, S., Chiba, T., Ooka, Y., Kanogawa, N., Motoyama, T., Suzuki, E., … Yokosuka, O. (2018). A randomized placebo-controlled trial of prophylactic dexamethasone for transcatheter arterial chemoembolization. Hepatology, 67(2), 575–585. https://doi.org/10.1002/hep.29419
6. Sacco, R., Tapete, G., Simonetti, N., Sellitri, R., Natali, V., Melissari, S., … Giacomelli, L. (2017). Transarterial chemoembolization for the treatment of hepatocellular carcinoma: A review. Journal of Hepatocellular Carcinoma, 4, 105–110. https://doi.org/10.2147/JHC.S113236
7. Song, M. J., Chun, H. J., Song, D. S., Kim, H. Y., Yoo, S. H., Park, C. H., … Yoon, S. K. (2012). Comparative study between doxorubicin-eluting beads and conventional transarterial chemoembolization for treatment of hepatocellular carcinoma. Journal of Hepatology, 57(6), 1244–1250. https://doi.org/10.1016/j.jhep.2012.07.017


댓글을 작성하려면 로그인이 필요합니다.